MALARIA
Translation into Spanish of an interesting article by Mark F. Wiser, associate professor and researcher with a special interest in the molecular and cellular biology of protozoan parasites and their interactions with hosts. Among his major research achievements, the description of proteins synthesized by the malaria parasite and exported to the host cell.
 1 August, 2022 Translation of an article about Malaria
1 August, 2022 Translation of an article about Malaria
A free translation by Chema, a Spain-based translator specializing in medical translations.
An original text written by Mark F. Wiser, originally published in
https://www.tulane.edu/~wiser/protozoology/notes/malaria.html
* * *
| Aspectos destacados históricos |
|---|
| 500 a.C. Hipócrates – Síntomas clínicos 1880 Laverán – Etapa de sangre 1898 Ross – Transmisión de mosquitos 1948 Garnham – Etapa del hígado |
La malaria ha sido y sigue siendo la causa de gran parte de la morbilidad y mortalidad humana. Aunque la enfermedad ha sido erradicada en la mayoría de las zonas templadas, continúa siendo endémica en gran parte de los trópicos y subtrópicos. El cuarenta por ciento de la población mundial vive en áreas endémicas. Las epidemias han devastado a grandes poblaciones y la malaria plantea un serio obstáculo para el progreso económico en muchos países en vías de desarrollo. Se estima que hay entre 300-500 millones de casos de enfermedad clínica por año y entre 1,5-2,7 millones de muertes. Algunos de los primeros escritos médicos conocidos de China, Asiria e India describen con precisión las fiebres intermitentes similares a las de la malaria. La primera descripción de los síntomas clínicos se le atribuye generalmente a Hipócrates, el “padre de la medicina”, en el año 500 a.C. (véase tabla). [Consulte también el artículo de Wikipedia sobre Historia de la malaria].
- Ciclo vital
- Manifestaciones clínicas
- Patogenia y paludismo cerebral
- Epidemiología y control
- Diagnóstico
- Quimioterapia y resistencia a los medicamentos
La malaria es causada por parásitos del género Plasmodium. Las especies de Plasmodium son Apicomplexa (consulte la descripción general de Apicomplexa) y exhiben un ciclo de vida heteroxeno que involucra un huésped vertebrado y un vector artrópodo. Los huéspedes vertebrados incluyen reptiles, pájaros, roedores, monos y humanos. Las especies de Plasmodium son generalmente específicas del huésped y del vector, ya que cada especie solo infectará una gama limitada de huéspedes y vectores. Cuatro especies distintas han infectado a los humanos: P. falciparum , P. vivax , P. ovale y P. malariae (Véase página sobre diferencias de especies). Las especies difieren en cuanto a su morfología, detalles de los ciclos de vida y manifestaciones clínicas.
Ciclo vital
Las especies de Plasmodium humanas y de otros mamíferos son transmitidas por mosquitos anofelinos. Al parásito se le inyecta la saliva durante la alimentación del mosquito y primero se somete a una ronda de merogonia en el hígado seguida de múltiples rondas de merogonia en los eritrocitos. La gametogonia comienza dentro de los eritrocitos del huésped vertebrado y se completa dentro del mosquito donde tiene lugar la esporogonia. Este ciclo de vida exhibe las características generales de otros parásitos Apicomplexa caracterizados por la reproducción asexual y la formación de etapas invasivas con orgánulos apicales típicos.
Etapa del hígado. La infección humana se inicia cuando se inyectan esporozoitos con la saliva durante la alimentación del mosquito. Los esporozoitos ingresan al sistema circulatorio y en un tiempo de entre 30 y 60 minutos invadirán una célula hepática. La entrada de la célula huésped, como en toda Apicomplexa, es facilitada por los orgánulos apicales. Después de invadir el hepatocito, el parásito experimenta una reproducción asexual. Esta etapa replicativa a menudo se denomina esquizogonia exoeritrocítica (o preeritrocítica). La esquizogonia se refiere a un proceso de reproducción en el que el parásito sufre múltiples rondas de división nuclear sin división citoplásmica seguida de una gemación o segmentación para formar descendencia. La descendencia, denominada merozoitos, se libera en el sistema circulatorio tras la ruptura del hepatocito huésped. (Consulte la figura del ciclo de vida).
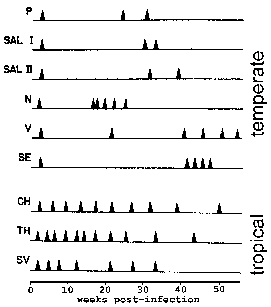
Se monitorizó a los monos en el momento de las recaídas tras infectarse con varios aislados. Las cepas de P. vivax aisladas de América del Norte exhiben un patrón de recaída “templado”, mientras que las del sureste de Asia exhiben un patrón de recaída “tropical”. Cita modificada de Contacos et al. en AJTMH 21:707, 1972.
En P. vivax y P. ovale , algunos de los esporozoítos no experimentan una reproducción asexual inmediata, sino que entran en una fase latente conocida como hipnozoíto. Sin embargo, se han planteado algunas preguntas sobre si P. ovale exhibe la etapa de hipnozoíto (Consulte Richter et al, 2010, Parasitology Research 107:1285). Este hipnozoíto puede reactivarse y sufrir esquizogonia en un momento posterior, lo que resulta en una recaída. La recaída tiene un significado específico con respecto a la malaria y se refiere a la reactivación de la infección a través de hipnozoítos. El recrudecimiento se utiliza para describir la situación en la que la parasitemia cae por debajo de los niveles detectables y luego aumenta a una parasitemia patente. Curiosamente, las cepas aisladas de regiones templadas tienden a exhibir un período de latencia más largo entre la infección primaria y la primera recaída que las cepas de regiones tropicales con transmisión continua (Figura).
Etapa de sangre. Los merozoítos liberados de las células hepáticas infectadas invaden los eritrocitos. Los merozoítos reconocen proteínas específicas en la superficie del eritrocito e invaden activamente la célula de manera similar a otros parásitos apicomplejos (Ver detalles sobre el mecanismo de invasión de la célula huésped). Después de introducirse en el eritrocito, el parásito pasa por un período trófico seguido de una replicación asexual. El trofozoíto joven a menudo se denomina forma del anillo debido a su morfología en frotis de sangre teñidos con Geimsa. A medida que el parásito aumenta de tamaño, esta morfología de “anillo” desaparece y se denomina trofozoíto. Durante el período trófico, el parásito ingiere el citoplasma de la célula huésped y descompone la hemoglobina en aminoácidos. Un subproducto de la digestión de la hemoglobina es el pigmento de la malaria o hemozoína (Véase las notas sobre la vacuola alimenticia de Plasmodium). Estos gránulos de colores marrones, dorados y negros se han reconocido durante mucho tiempo como una característica distintiva de los parásitos en etapa sanguínea.
La división celular marca el final de la etapa de trofozoíto y el comienzo de la etapa de esquizonte . La esquizogonia eritrocítica consta de 3 a 5 rondas (según la especie) de reproducción celular seguida de un proceso de gemación. Los esquizontes de etapa tardía en los que los merozoítos individuales se vuelven discernibles se denominan segmentadores . El eritrocito huésped se rompe y libera los merozoítos. Estos merozoítos invaden nuevos eritrocitos e inician otra ronda de esquizogonia. Los parásitos en etapa sanguínea dentro de un huésped generalmente experimentan una esquizogonia sincrónica. La ruptura simultánea de los eritrocitos infectados y la liberación concomitante de antígenos y productos de desecho explican los paroxismos febriles intermitentes asociados con el paludismo. La esquizogonia en etapa sanguínea en P. falciparum difiere de los otros parásitos palúdicos humanos en que los eritrocitos infectados con trofozoítos y esquizontes se adhieren a las células endoteliales capilares y no se encuentran en la circulación periférica. Este secuestro se asocia con la malaria cerebral (Consulte la figura del ciclo de vida).
Etapa sexual . Como alternativa a la esquizogonia, algunos de los parásitos experimentarán un ciclo sexual y se diferenciarán terminalmente en micro o macrogametocitos. No se conocen los factores involucrados en la inducción de la gametocitogenesis. Sin embargo, el compromiso con la etapa sexual ocurre durante el ciclo eritrocitario asexual que precede inmediatamente a la formación de gametocitos. Los merozoítos creados a partir de este esquizonte se desarrollarán en todas las formas asexuales o sexuales. Los gametocitos no causan patología en el huésped humano y desaparecerán de la circulación si no son absorbidos por un mosquito.
La gametogenesis, o la formación de micro y macrogametos, se induce cuando un mosquito ingiere los gametocitos. Después de la ingestión por el mosquito, el microgametocito pasa por tres rondas de reproducción celular. Estos ocho núcleos luego se unen a flagelos que emergen del cuerpo del microgametocito. Este proceso es fácilmente observable por microscopía de luz debido a los flagelos que golpean y se llama exflagelación. Los macrogametocitos pasan a ser macrogametos. Sin embargo, a nivel morfológico esto es mucho menos dramático que la exflagelación exhibida por los microgametocitos.
| Gametogenesis/Exflagelación |
|---|
| Ocurre espontáneamente después de la exposición al aire: ↓ temperatura (2-3 o C) ↓ pCO2 ↑ pH (8-8.3) El factor de exflagelación derivado de mosquitos reduce el pH permisivo MEF = ácido xanturénico |
La exflagelación ocurre espontáneamente cuando la sangre infectada se expone al aire. Los factores críticos involucrados en la inducción de esta gametogenesis son una disminución de la temperatura, una disminución del dióxido de carbono disuelto y el posterior aumento del pH por encima de 8,0 (Véase cuadro). Esto imita de alguna manera los cambios ambientales experimentados por los gametocitos en los que hay un cambio en la temperatura ambiente y el intestino del mosquito exhibe un pH de aproximadamente 7,8 en comparación con un pH de 7,4 para la sangre. Además, también se ha descrito e identificado un factor de exflagelación derivado de mosquitos (MEF) como ácido xanturénico, un metabolito de los insectos. El ácido xanturénico reduce el pH permisivo para la exflagelación por debajo de 8,0 y posiblemente sea una señal biológica para que el parásito experimente gametogenesis.(Billker et al., Nature 392:289, 1998; Billker et al, Cell 117:503, 2004) .
Los microgametos altamente móviles buscarán y se fusionarán con un macrogameto. Dentro de 12 a 24 horas, el cigoto resultante se convierte en un oocineto . El oocineto es una etapa invasiva móvil que atravesará tanto la matriz peritrófica como el epitelio del intestino medio del mosquito. Atravesar el epitelio del intestino medio implica invadir y salir de varias células epiteliales antes de emerger en el lado basal del epitelio. El proceso de invasión es similar al de otros Apicomplexa excepto que el oocineto no tiene roptrias y no forma una vacuola parasitófora después de invadir la célula huésped (Ver detalles sobre el mecanismo de invasión de la célula huésped).
Esporogonia . Después de alcanzar el espacio extracelular entre las células epiteliales y la lámina basal, el oocineto se convierte en un ooquiste . Los ooquistes se someten a una reproducción asexual, llamada esporogonia, que culmina en la producción de varios miles de esporozoítos . Esto generalmente tiene una duración de entre 10 y 28 días dependiendo de la especie y la temperatura. Al madurar, el ooquiste se rompe y libera los esporozoítos que cruzan la lámina basal hacia el hemocele (cavidad corporal) del mosquito (Consulte la figura del ciclo de vida).
Estos esporozoitos son móviles y tienen la capacidad de reconocer específicamente las glándulas salivales. Después de encontrar las glándulas salivales, los esporozoítos invadirán y atravesarán las células epiteliales de las glándulas salivales y llegarán a permanecer dentro de su luz. Algunos de estos esporozoítos serán expulsados al huésped vertebrado cuando el mosquito ingiere sangre y, por lo tanto, reinician la infección en el huésped vertebrado . Aunque los esporozoítos del hemocele y de las glándulas salivales son morfológicamente similares, son funcionalmente distintos. Los esporozoítos de las glándulas salivales invaden de forma eficaz las células del hígado, pero no pueden volver a invadir las glándulas salivales, mientras que los esporozoítos del hemocele no pueden invadir las células del hígado.
En resumen, el parásito de la malaria manifiesta un ciclo de vida con características de Apicomplexa típicas. Hay tres etapas invasivas distintas: esporozoíto, merozoíto y oocineto. Todos se caracterizan por tener orgánulos apicales y pueden invadir o atravesar las células huésped. Se observan dos tipos distintos de merogonia. La primera, llamada esquizogonia exoeritrocítica, ocurre en el hígado y es iniciada por el esporozoíto. Luego, los merozoítos resultantes invaden los eritrocitos y se someten a repetidas rondas de merogonia denominada esquizogonia eritrocítica. Algunos de los merozoítos producidos a partir de la esquizogonia eritrocítica sufrirán gamogonia. La gamogonia de Plasmodium se describe en dos fases: la gametocitogenesis que se produce en el torrente sanguíneo del huésped vertebrado y la gametogenesis que se produce en el intestino del mosquito. Los gametos se fusionan para convertirse en un cigoto que primero se convierte en un oocineto y luego se convierte en un ooquiste donde tiene lugar la esporogonia.
(Para una revisión del ciclo de vida dentro del mosquito, consulte LA Baton, LC Ranford-Cartwright (2005) Spreading the Seeds of Million-Murdering Death: Metamorphoses of Malaria in the Mosquito. Trends in Parasitology 21, 573-580 .
Manifestaciones clínicas
La patología y las manifestaciones clínicas asociadas con la malaria se deben casi exclusivamente a los parásitos en etapa eritrocitaria asexual. Los esquizontes tisulares y los gametocitos causan poca o ninguna patología. La infección por Plasmodium causa una enfermedad febril aguda que se caracteriza por sus paroxismos febriles periódicos que ocurren en intervalos de 48 o 72 horas. La gravedad del ataque depende de la especie de Plasmodium , así como de otras circunstancias, como el estado de inmunidad y el estado general de salud y nutrición del individuo infectado. La malaria es una enfermedad crónica que tiene una tendencia a recaer o recrudecer (ver explicación de la diferencia) durante meses o incluso años.
La forma más común de contraer la malaria es a través de la transmisión natural por mosquitos (ver ciclo de vida). La malaria también se puede transmitir a través de transfusiones de sangre o compartiendo jeringillas. La transmisión mecánica de sangre infectada resultará en un período de incubación más corto ya que no habrá etapa hepática. También existe un mayor riesgo de muerte con P. falciparum transmitido mecánicamente. La falta de infección en la etapa hepática también impide las recaídas en las infecciones por P. vivax o P. ovale . También se ha documentado la transmisión congénita, pero se cree que es relativamente rara a pesar de la fuerte infección de la placenta.
| Esquizogonia exoeritrocítica y períodos prepatente y de incubación |
|---|
| P falciparumP. vivaxP. ovaleP. malariaePeríodo de prepatente (días)6-98-1210-1415-18Período de incubación (días)7-1412-1716-1818-40Maduración del merozoíto (días)5-76-8912-16Merozoítos producidos40,00010,00015,0002000 |
Los síntomas de la malaria generalmente comienzan a aparecer entre 10 y 15 días después de la picadura de un mosquito infectado. Los períodos prepatentes y de incubación típicos después de la inoculación de esporozoítos varían según la especie (Tabla). El período prepatente se define como el tiempo entre la inoculación de esporozoítos y la aparición de parásitos en la sangre y representa la duración de la etapa hepática y el número de merozoítos producidos. Los períodos de incubación tienden a ser un poco más largos y se definen como el tiempo entre la inoculación de esporozoítos y la aparición de los síntomas. A veces , los períodos de incubación pueden prolongarse durante varios meses en P. vivax, P. ovale y P. malariae. Las cuatro especies pueden exhibir síntomas prodrómicos no específicos unos días antes de la primera fiebre. Estos síntomas prodrómicos generalmente se describen como “similares a la gripe” e incluyen: dolor de cabeza, fiebre leve, dolor muscular, anorexia, náuseas y cansancio. Los síntomas tienden a relacionarse con distintos tipos de parásitos.
Estos síntomas prodrómicos serán seguidos por ataques febriles también conocidos como paroxismos palúdicos. Estos paroxismos exhibirán periodicidades de 48 horas para P. vivax, P. ovale y P. falciparum , y de 72 horas para P. malariae. Inicialmente, la periodicidad de estos paroximos puede ser irregular a medida que se sincronizan las crías de merozoítos de diferentes esquizontes exoeritrocitarios. Esto es especialmente cierto en P. falciparum , que puede no presentar paroxismos distintos, pero presenta fiebre continua, ataques diarios o ataques irregulares (por ejemplo, periodicidad de 36 a 48 horas). Los pacientes también pueden presentar esplenomegalia, hepatomegalia (ictericia leve) y anemia hemolítica durante el período en que ocurren los paroxismos palúdicos.
| El paroxismo palúdico |
|---|
| Etapa fría – Sensación de frío intenso – Escalofríos fuertes – Duración de 15-60 minutos Etapa caliente – Calor intenso – Piel seca quemada – Dolor de cabeza palpitante – Duración de 2-6 horas Etapa de sudor – Abundante sudoración – Temperatura decreciente – Agotado y débil → dormir -Duración de 2-4 horas |
El paroxismo palúdico (ver Tabla) generalmente dura de 4 a 8 horas y comienza con una aparición repentina de escalofríos en los que el paciente experimenta una intensa sensación de frío a pesar de tener una temperatura elevada. Esto a menudo se conoce como la etapa fría y se caracteriza por escalofríos fuertes. Inmediatamente después de esta etapa fría está la etapa caliente. El paciente siente un intenso calor acompañado de fuerte dolor de cabeza. La fatiga, los mareos, la anorexia, la mialgia y las náuseas a menudo se asocian con la etapa caliente. A continuación, se producirá un período de sudoración profusa y la fiebre comenzará a disminuir. El paciente está exhausto y débil y por lo general se queda dormido. Al despertar, aparte de estar cansado, generalmente se siente bien y no presenta síntomas hasta el inicio del siguiente paroxismo.
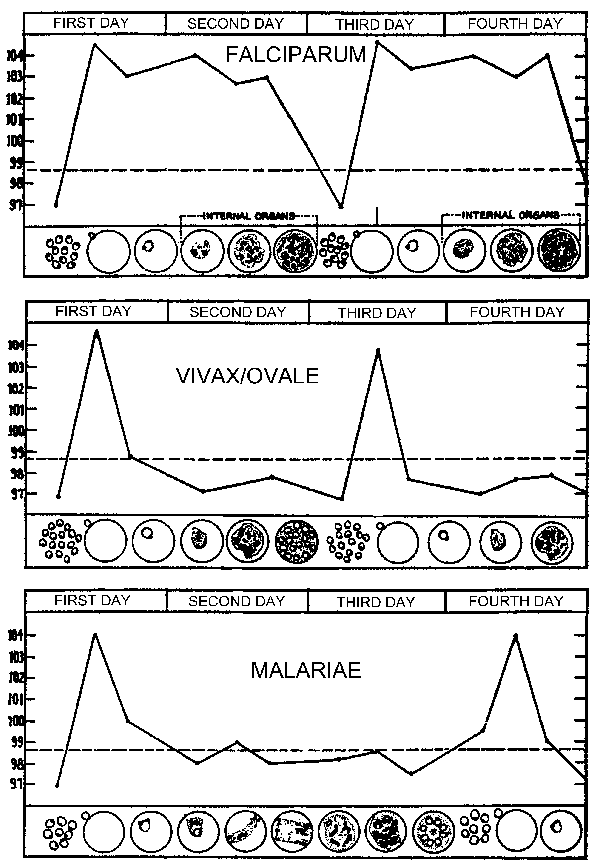
Un patrón típico de temperatura (fiebre) en relación con la esquizogonia en etapa sanguínea para los parásitos de la malaria humana. El paroxismo febril corresponde al período de ruptura de eritrocitos infectados e invasión de merozoítos (Figura modificada de Neva y Brown, Basic Clinical Parasitology, 6th ed., 1994).
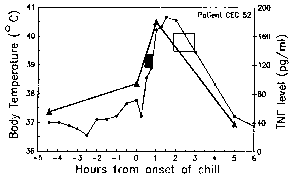
La periodicidad de estos paroxismos se debe al desarrollo sincrónico del parásito de la malaria dentro del huésped humano. En otras palabras, todos los parásitos dentro de un huésped se encuentran aproximadamente en la misma etapa (es decir, anillo, trofozoíto, esquizonte) a medida que avanzan a través de la esquizogonia. El paroxismo palúdico corresponde a la ruptura de los eritrocitos infectados y la liberación de merozoítos (Figura anterior). La periodicidad de 72 horas en P. malariae se debe a su crecimiento y maduración más lentos durante la esquizogonia del estadio sanguíneo. Estudios en P. vivaxhan han demostrado una correlación entre la fiebre y los niveles séricos de TNF-α (factor de necrosis tumoral alfa) (Figura derecha). Presuntamente, se liberan antígenos o toxinas cuando el eritrocito infectado se rompe y conduce a la producción de TNF-α y los ataques febriles.
La gravedad de los paroxismos y la duración de los síntomas varía según la especie (véase la tabla a continuación). En general, la severidad de la enfermedad se correlaciona con la parasitemia promedio y máxima exhibida por las diversas especies. P. falciparum es capaz de producir una infección grave y letal, mientras que las otras especies rara vez son mortales. Los pacientes infectados con P. vivax , especialmente por primera vez, pueden llegar a estar muy enfermos. Sin embargo, rara vez causa complicaciones o provoca la muerte. En ocasiones, también se ha observado paludismo grave que afecta a múltiples órganos en infecciones por P. vivax (véase Kochar et al, EID 11 (1), enero de 2005). Recaídas a la activación de P. vivaxlos hipnozoítos pueden ocurrir durante varios años. P. ovale es la más benigna porque los paroxismos tienden a ser leves y de corta duración y las recaídas rara vez ocurren más de un año después de la infección inicial. P. malariae generalmente produce una enfermedad leve, pero los paroxismos iniciales pueden ser de moderados a severos. Sin embargo, es la más crónica y se han documentado recrudecimientos varias décadas después de la infección inicial. Esta cronicidad a veces se asocia con complicaciones renales, que probablemente se deban al depósito de complejos antígeno-anticuerpo en los glomérulos del riñón. Los paroxismos palúdicos se volverán menos severos e irregulares en periodicidad a medida que el huésped desarrolle inmunidad. Esta inmunidad, sin embargo, no es una inmunidad esterilizante en el sentido de que la infección persiste más tiempo que los síntomas y los individuos pueden presentar recaídas o recrudecimientos o volverse a infectar. Si no se tratan, todas las formas de malaria tienden a ser crónicas.
| Gravedad y duración de la enfermedad |
|---|
| vivaxovaladopaludismofalciparumSeveridad inicial del paraoxismomoderado a severotempladomoderado a severoseveroParasitemia promedio (mm 3 )20,0009,0006,00050,000-500,000Parasitemia máxima (mm 3 )50,00030,00020,0002,500,000Síntoma Duración (sin tratamiento)3-8+ semanas2-3 semanas3-24 semanas2-3 semanasDuración máxima de la infección (sin tratar)5-8 años12-20 meses20-50+ años6-17 mesesAnemia+++++++++ComplicacionesrenalcerebralModificado de Parasitología médica de Markell y Voge |
| Aumento de la morbilidad y mortalidad del paludismo falciparum |
|---|
| – Todos los eritrocitos invadidos – Gran número de merozoítos – Secuestro – Evasión inmune – Complicaciones |
A diferencia de las otras tres especies, P. falciparum puede producir enfermedades graves con consecuencias mortales. Este aumento de la morbilidad y la mortalidad se debe en parte a las altas parasitemias asociadas con las infecciones por P. falciparum . Estas parasitemias potencialmente elevadas se deben en parte al gran número de merozoítos producidos ya la capacidad de P. falciparum para invadir todos los eritrocitos. Por el contrario, P. vivax y P. ovale prefieren reticulocitos (es decir, eritrocitos inmaduros), mientras que P. malariae prefiere eritrocitos senescentes ( ver diferencias entre especies). La parasitemia también puede aumentar rápidamente debido a la citoadherencia y secuestro de P. falciparum . Este secuestro en los tejidos minimiza la eliminación de eritrocitos infectados por el bazo y permite una invasión de eritrocitos más eficiente. La anemia se debe en parte a la destrucción de los eritrocitos durante la esquizogonia en etapa sanguínea. Además, los eritrocitos no infectados se destruyen a un ritmo mayor durante la infección y hay una disminución de la producción de eritrocitos.
Patogenia y paludismo cerebral
La patología asociada con todas las especies palúdicas está relacionada con la ruptura de eritrocitos infectados y la liberación de material parasitario y metabolitos, hemozoína (es decir, pigmento palúdico) y restos celulares. Además de los paroxismos discutidos anteriormente, la deposición de hemozoína se conoce desde hace mucho tiempo como un rasgo característico de la malaria. Hay un aumento de la actividad del sistema reticuloendotelial, particularmente en el hígado y el bazo y, por lo tanto, su agrandamiento, como lo demuestran los macrófagos con eritrocitos y hemozoína infectados y normales ingeridos. Con excepción de P. falciparum , la patología asociada con la malaria tiende a ser benigna. Varias complicaciones graves pueden estar asociadas con la malaria falciparum, siendo la malaria cerebral la más notable y una causa frecuente de muerte.
| Paludismo cerebral |
|---|
| – Complicación de la malaria falciparum grave – Una encefalopatía difusa con pérdida de conciencia – La conciencia va del estupor al coma – El inicio puede ser gradual o rápido – No responde al dolor, estímulos visuales y verbales – Asociado con el secuestro en la microvasculatura cerebral |
La malaria cerebral se caracteriza por un deterioro de la conciencia (ver recuadro). Los síntomas de presentación son cefalea intensa seguida de somnolencia, confusión y, finalmente, coma. Las convulsiones también se asocian con frecuencia a la malaria cerebral. Se cree que estas manifestaciones neurológicas se deben al secuestro de los eritrocitos infectados en la microvasculatura cerebral. El secuestro se refiere a la citoadherencia de eritrocitos infectados con trofozoítos y esquizontes a las células endoteliales de lechos vasculares profundos en órganos vitales, especialmente cerebro, pulmón, intestino, corazón y placenta. Este secuestro proporciona varias ventajas para el parásito. La principal ventaja es la eliminación del bazo y la subsiguiente eliminación de los eritrocitos infectados. Además, las bajas tensiones de oxígeno en los tejidos profundos pueden proporcionar un mejor entorno metabólico.
La citoadherencia parece estar mediada por las protuberancias densas en electrones en la superficie del eritrocito infectado. Estos “botones” se expresan durante las etapas de trofozoíto y esquizonte y se forman como resultado de las proteínas del parásito exportadas a la membrana de los eritrocitos. Entre las especies humanas de Plasmodium , las protuberancias están restringidas a P. falciparum y, por lo tanto, sugieren que las protuberancias desempeñan un papel en la citoadherencia. Además, también existe una buena correlación entre las especies animales de Plasmodium que expresan protuberancias y exhiben secuestro. La microscopía electrónica también muestra que las protuberancias son puntos de contacto entre el eritrocito infectado y la célula endotelial.
| Pf EMP-1 |
|---|
| – Expuesto en la superficie de los eritrocitos infectados – Se une a los posibles receptores del huésped – Miembro de la familia de genes var |
Los mecanismos moleculares de la citoadherencia implican interacciones receptor-ligando. En otras palabras, las proteínas expresadas en la superficie del eritrocito infectado (ligando) se unirán a las proteínas expresadas en la superficie de las células endoteliales (receptor). Pf EMP-1 (proteína de membrana de eritrocitos) es una proteína de parásito que se ha implicado como ligando de citoadherencia (Recuadro ) . En contraste con la naturaleza generalmente altamente conservada de las interacciones receptor-ligando, Pf EMP-1 es un miembro de una familia de genes
muy variable (= var) con 40-50 genes diferentes. Se han identificado varias proteínas huésped que posiblemente funcionen como receptores (véase el recuadro a continuación). Muchas de estas proteínas huésped funcionan en interacciones célula-célula y están implicadas en la adhesión celular. Varios estudios han indicado que la expresión de diferentes genes Pf EMP-1 se correlaciona con diferentes fenotipos de unión al receptor. Esta variación antigénica asociada con la Pf EMP-1 expuesta a la superficie permite que el parásito eluda el sistema inmunitario. Sin embargo, la función de citoadherencia se conserva a través de su capacidad para reconocer múltiples receptores (Figura). Esta variación antigénica también puede explicar los diferentes resultados de la enfermedad. Por ejemplo, la molécula de adhesión intercelular-1 (ICAM-1) suele estar implicada en la patología cerebral.
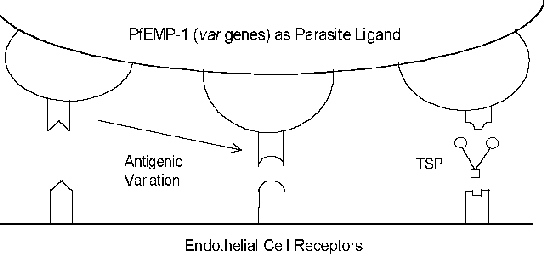
| Posibles receptores |
| – CD36 – Super-familia Ig – ICAM-1 – VCAM-1 – PE-CAM-1 – E-selectina – Trombospondina (TSP) – Sulfato de condroitina A – Receptores de formación de rosetas – CR-1 – Glicosaminoglicano |
Las primeras observaciones de la patología de la malaria cerebral sugirieron una relación entre un gran número de eritrocitos infectados en la microvasculatura y el desarrollo del síndrome. Inicialmente se supuso que la citoadherencia conduciría a un bloqueo mecánico (es decir, isquemia cerebral) y posteriormente a la hipoxia. Además, el parásito también podría causar efectos metabólicos localizados como hipoglucemia y/o acidosis láctica. La hipoxia y los efectos metabólicos provocarían entonces el coma y la posterior muerte. Sin embargo, hay algunos problemas con la hipótesis del secuestro:
- el coma asociado con la malaria cerebral es rápidamente reversible con el tratamiento,
- un alto porcentaje de sobrevivientes no tiene complicaciones neurológicas permanentes,
- falta de daño isquémico (descarta la hipoxia como mecanismo principal),
- el secuestro también ocurre en la malaria no cerebral.
| Secuelas neurológicas entre sobrevivientes de malaria cerebral: |
| – 23,3 % al alta – 8,6% a un mes – 4,4% a los seis meses van Hansbroek (1997) J. Ped. 131:125 |
Debido a estos problemas, otros han sugerido que el coma está mediado por moléculas de vida corta que afectan la función cerebral. Los posibles mediadores del huésped incluyen citocinas, como TNF- α u óxido nítrico. En esta teoría de las citoquinas, los antígenos de la malaria estimularían el TNF-α, que luego podría inducir el óxido nítrico o tener otros efectos patológicos. Se sabe que el óxido nítrico afecta la función neuronal y también podría provocar hipertensión intracraneal, por su actividad vasodilatadora. Sin embargo, es poco probable que la liberación sistémica de citocinas provoque un coma y también es necesario postular que la liberación de estos mediadores en el cerebro conduciría a concentraciones locales elevadas. Además, hay una mínima infiltración de linfocitos o inflamación asociada con los capilares bloqueados.
La hipótesis del secuestro y la teoría de las citocinas para la fisiopatología de la malaria cerebral no son mutuamente excluyentes, y es probable que ambos fenómenos estén involucrados. Por ejemplo, se sabe que los exoantígenos de parásitos, que se liberan en la ruptura de los eritrocitos, estimulan a los macrófagos para que secreten TNF-α. Se sabe que el TNF-α aumenta la expresión de moléculas de adhesión como ICAM-1 en la superficie de las células endoteliales del cerebro. Esto conduciría a aumentar la unión de los eritrocitos infectados y amplificar los efectos, ya sea debido a un bloqueo vascular, mediadores solubles , efectos metabólicos o una combinación (Figura).
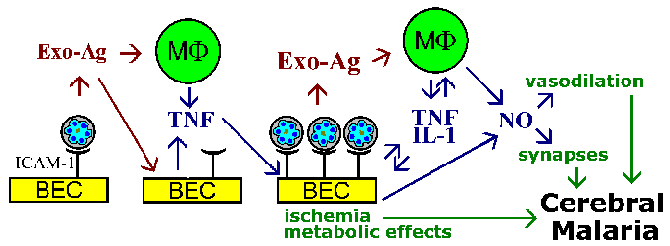
La citoadherencia de los eritrocitos infectados a las células endoteliales del cerebro (BEC) y la liberación de exoantígenos podrían estimular las BEC y las células efectoras inmunitarias como los macrófagos (MF) para secretar citocinas. Estas citocinas, como el factor de necrosis tumoral -α, (TNF), conduciría a un aumento de la expresión de posibles receptores de células endoteliales (p. ej., ICAM-1) y promovería un aumento de la citoadherencia de los eritrocitos infectados. Un gran número de eritrocitos infectados unidos podría provocar bloqueo vascular e hipoxia y tener efectos metabólicos localizados (p. ej., hipoglucemia, acidosis láctica). El mayor número de eritrocitos infectados y exoantígenos también conduciría a niveles más altos de citoquinas. TNF-α también se sabe que estimula el óxido nítrico (NO).
El óxido nítrico puede afectar la función neuronal al interferir con la neurotransmisión.
El óxido nítrico también provoca vasodilatación que podría conducir a la hipertensión intracraneal asociada con la malaria cerebral.
Figura adaptada de Pasloske y Howard (Annu. Rev. Med. 45:283, 1994).
En resumen:
- P. falciparum puede causar una enfermedad grave y mortal
- Esta patogenicidad aumentada en comparación con otra malaria humana está relacionada con P. falciparum:
- alta capacidad reproductiva
- citoadherencia y secuestro
- El secuestro contribuye a una mayor capacidad reproductiva a través de la evitación del bazo
- La citoadherencia a las células endoteliales también podría tener efectos patológicos locales y, en particular, probablemente esté involucrada en la malaria cerebral
- la fisiopatología de la malaria cerebral no se comprende por completo, pero es probable que involucre múltiples factores e interacciones complejas entre el huésped y el parásito
Reseñas sobre paludismo grave y patogenia:
- IA Clark, WB Cowden (2003) “La fisiopatología de la malaria falciparum”. Farmacología y Terapéutica 99, 221-260.
- R Idro, NE Jenkins, CRJC Newton (2005) “Patogénesis, características clínicas y resultado neurológico de la malaria cerebral”. The Lancet Neurology 4, 827-840.
- CL Mackintosh, JG Beeson, K Marsh (2004) “Características clínicas y patogenia de la malaria grave”. Tendencias en Parasitología 20, 597-603.
- A Trampuz, M Jereb, I Muzlovic, RM Prabhu (2003) “Revisión clínica: paludismo grave”. Cuidados Críticos 7, 315-323.
Epidemiología y control
| Ir a la sección sobre: – Inmunidad – Genética Humana – Malaria en EE. UU. – Control |
La malaria es principalmente una enfermedad de los trópicos y subtrópicos y está muy extendida en las regiones cálidas y húmedas de África, Asia y América del Sur y Central. La enfermedad también era común en muchas áreas templadas, incluidos los EE. UU., Europa y el norte de Eurasia y Asia, pero ha sido erradicada. En muchas áreas que anteriormente tenían la malaria bajo control están experimentando un resurgimiento (véase artículo en The Atlantic). Las cuatro especies palúdicas humanas exhiben una distribución geográfica superpuesta (véase Tabla). P. vivax y P. falciparum son las especies más comunes, siendo P. vivax la más extendida geográficamente. Las infecciones mixtas son comunes en áreas endémicas. Los métodos moleculares sugieren queP. malariae y P. ovale podrían estar más extendidos y prevalecer de lo que se pensaba anteriormente (véase Mueller et al., Tr. Parasitol. 23:278 , 2007).
| Distribuciones Geográficas |
|---|
| vivaxfalciparumpaludismoovaladogeneralizada en áreas tropicales y subtropicalesrango se extiende a las zonas templadasrelativamente poco común en Áfricageneralizada, pero principalmente en los trópicos y subtrópicosdistribución geográfica amplia, pero irregularprincipalmente África tropical, especialmente la costa occidental |
| Epidemiología de la malaria |
|---|
| Paludismo estable o endémico – Incidencia sostenida durante varios años – Incluye transmisión estacional – Varios niveles de endemicidad – La inmunidad y la tolerancia a las enfermedades se correlacionan con la endemicidad – Epidemias improbables Paludismo inestable o epidémico – Marcado aumento en la incidencia – La población no es inmune – La morbilidad y la mortalidad pueden ser altas |
La epidemiología de la malaria puede verse en términos de ser estable (endémica) o inestable (epidémica). La malaria estable se refiere a una situación en la que hay una incidencia medible de transmisión natural durante varios años. Esto también incluiría áreas que experimentan transmisión estacional. Diferentes áreas pueden experimentar diferentes niveles de tasas de incidencia y esto a menudo se denota por: hipoendémico, mesoendémico, hiperendémico y holoendémico. Las personas que viven en áreas altamente endémicas suelen exhibir un alto nivel de inmunidad y toleran bien la infección.
La malaria inestable o epidémica se refiere a un aumento de la malaria en áreas de baja endemicidad o a brotes en áreas previamente sin malaria o entre personas no inmunes. Estos brotes generalmente se pueden atribuir a cambios en el comportamiento humano o efectos en el medio ambiente. Por ejemplo, la migración humana y el reasentamiento pueden introducir la malaria en un área o exponer a una población previamente no inmune a la transmisión endémica. Los cambios en la ecología causados por desastres naturales o proyectos de obras públicas, como la construcción de carreteras, también pueden afectar la transmisión de la malaria y provocar epidemias.
"Todo sobre la malaria está tan moldeado por las condiciones locales que se convierte en un millar de rompecabezas epidemiológicos".Hackett (1937)
La cita anterior enfatiza la complejidad de la malaria y las múltiples facetas que presenta la enfermedad. Diferentes comunidades experimentarán una malaria diferente y, en consecuencia, pueden ser necesarias diferentes estrategias de control y tratamiento. Las complejas interacciones entre el huésped, el parásito y el vector son los principales factores de esta complejidad epidemiológica.
Por ejemplo, como ocurre con todas las enfermedades transmitidas por vectores, el parásito debe poder establecer una infección crónica dentro del huésped para maximizar las oportunidades de transmisión. Esto es especialmente cierto en el caso de la transmisión estacional y en áreas de baja endemicidad. Y, en general, las infecciones por paludismo se caracterizan por una fase aguda inicial seguida de una fase crónica relativamente asintomática más prolongada. Esto se debe en parte a la capacidad del parásito para evitar la eliminación completa por parte del sistema inmunitario. Por ejemplo, P. falciparum presenta una variación antigénica que le permite estar un paso por delante del sistema inmunitario. Además, P. vivax y P. ovale presentan la etapa de hipnozoíto y son capaces de recaer. Esto permite que el parásito mantenga la infección dentro del huésped humano incluso después de que se haya eliminado la etapa sanguínea de la infección. El intervalo relativamente largo entre las recaídas en algunos aislamientos de P. vivax probablemente explica su capacidad para mantener los ciclos de transmisión en algunos climas templados.
Varios estudios de epidemiología molecular han indicado que P. falciparum también puede producir infecciones crónicas a largo plazo (véase Roper et al. más adelante).
| Roper et al. (1996) AJTMH 54:325 Sitio de estudio =este de Sudán (mesoendémica, transmisión estacional) – temporada de lluvias = junio-septiembre – pico de casos sintomáticos = oct-nov Métodos: seguimiento de una cohorte de 79 individuos durante un año mediante frotis de sangre gruesa y PCR Resultados: las tasas de incidencia son constantes a lo largo de la estación seca en ausencia de transmisión y enfermedad sintomática (Tabla derecha) Estudios posteriores muestran que la mayoría de los individuos estaban infectados con un parásito del mismo genotipo durante la estación seca (Parasitol. 120:447, 2000) | Fecha de prueba% Incidencia (frotis/PCR) *93 de septiembre94 de enero13% (2/8)19% (4/11)}33% informó síntomasabr 9494 de junio24% (8/11)19% (0/14)}sin casos sintomáticos*Número de personas que dieron positivo por frotis de sangre y PCR. El ensayo de PCR detecta ~2,5 parásitos/ m l (4-10 veces más sensible que los frotis gruesos). |
Con respecto al huésped, los humanos son el único reservorio significativo del parásito y la transmisión sostenida depende de mantener un grupo de individuos infectados y el contacto entre los humanos y los mosquitos anofelinos. Varios factores influyen en la susceptibilidad de los seres humanos a la infección. Obviamente, el estado inmunitario del individuo y su experiencia previa con la malaria influirán en el curso de la infección. Las mujeres embarazadas, especialmente durante el primer embarazo, son más susceptibles a la malaria falciparum, como lo ilustra una mayor prevalencia de infección y parasitemias. Además, ciertas enfermedades genéticas y polimorfismos se han asociado con una disminución de infecciones o enfermedades (véase Resistencia innata).
El potencial del mosquito para servir como vector depende de la capacidad de soportar la esporogonia, la abundancia de mosquitos y el contacto con los humanos, todos los cuales están influenciados por factores climáticos y ecológicos (Tabla). La capacidad de soportar la esporogonia depende en gran medida de la especie, ya que no todas las especies de Anopheles son susceptibles a la infección por Plasmodium . La temperatura y la longevidad del mosquito son otros factores clave que afectan la interacción del parásito con el vector. El desarrollo de P. falciparum requiere una temperatura mínima de 20 o C, mientras que la temperatura mínima para las demás especies es de 16 oC. La temperatura también afecta el tiempo de desarrollo ya que la duración de la esporogonia es sustancialmente más corta a temperaturas más altas. Una duración más corta de la esporogonia aumenta las posibilidades de que el mosquito transmita la infección durante su vida útil.
| Factores que influyen en la capacidad vectorial |
|---|
| Esporogonia – La temperatura – Longevidad de los mosquitos – Especies de mosquitos Densidad de mosquitos – La temperatura – Altitud – Lluvia – Criaderos Contacto humano – Antropofílico – Interior vs exterior – Hora de la comida |
La densidad de mosquitos y los hábitos de alimentación también influyen en la transmisión de la malaria. La densidad de mosquitos se ve afectada por la temperatura, la altitud, las precipitaciones y la disponibilidad de criaderos, mientras que el contacto humano-mosquito se verá influido por el comportamiento del mosquito. Por ejemplo, el grado en que una especie de mosquito en particular es antropofílica influirá en la probabilidad de que el mosquito se infecte y luego transmita la infección a otro ser humano. Estas tendencias antropofílicas son necesariamente absolutas en el sentido de que muchos mosquitos zoofílicos cambiarán a humanos si las densidades alcanzan niveles altos o la fuente animal preferida disminuye. El tiempo de alimentación preferido y si el mosquito se alimenta predominantemente en interiores o exteriores influirá en la dinámica de transmisión. Por ejemplo, los mosquitos que se alimentan al aire libre tienen más probabilidades de encontrar una comida de sangre humana temprano en la noche que los que se alimentan tarde en la noche cuando la mayoría de las personas están en interior. El comportamiento del mosquito también debe tenerse en cuenta en las actividades de control.
| “Paradójicamente, los riesgos de enfermedad grave en la infancia fueron más bajos entre las poblaciones con las intensidades de transmisión más altas, y los riesgos de enfermedad más altos se observaron entre las poblaciones expuestas a intensidades de transmisión de bajas a moderadas”. Nieve et al. (1997) Lancet 349: 1650 |
Inmunidad
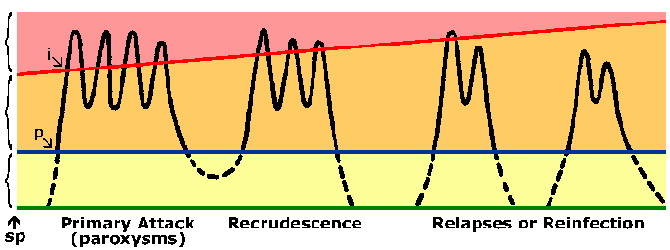
Las personas que viven en áreas endémicas desarrollan inmunidad contra la malaria. Casi siempre una persona presentará síntomas durante su exposición inicial a la malaria. Sin embargo, los síntomas asociados con exposiciones posteriores a la malaria suelen ser menos graves. La inmunidad contra la malaria se desarrolla lentamente y requiere múltiples exposiciones. En áreas altamente endémicas, solo los niños pequeños corren un alto riesgo de desarrollar paludismo grave por P. falciparum, mientras que los niños mayores y los adultos están esencialmente protegidos contra enfermedades graves y la muerte. Sin embargo, esta inmunidad no es una inmunidad esterilizante en el sentido de que las personas aún pueden infectarse. Además, la inmunidad es de corta duración y, en ausencia de exposición repetida, el nivel de inmunidad disminuye. Por ejemplo, los adultos previamente semiinmunes a menudo desarrollarán malaria grave al regresar a un área endémica después de haber estado en un área no endémica durante 1 o 2 años. Este estado de inmunidad parcial en el que la parasitemia se reduce, pero no se elimina, y se tolera mejor (Figura) a veces se denomina premunición. La premunición se refiere a una inmunidad que depende de la presencia del patógeno.
La respuesta inmunitaria podría estar dirigida a las etapas preeritrocítica o eritrocítica del ciclo de vida del parásito. Sin embargo, la etapa eritrocitaria del ciclo de vida es probablemente la más importante en términos de eliminación del parásito y disminución de la enfermedad. Debido a la falta de moléculas HLA en la superficie del parásito o del eritrocito, generalmente se supone que el anticuerpo desempeñará un papel clave en la inmunidad del estadio sanguíneo. Los posibles mecanismos efectores de los anticuerpos incluyen: bloqueo de la invasión de eritrocitos por merozoítos, muerte celular dependiente de anticuerpos mediada por anticuerpos citofílicos o aumento de la eliminación de eritrocitos infectados debido a la unión de anticuerpos a antígenos del parásito expuestos en la superficie de los eritrocitos. Todo ello redundará en una menor parasitemia. La importancia relativa de estos diversos mecanismos no está clara y probablemente la inmunidad requiera que se generen anticuerpos contra numerosas dianas. Esto, junto con la variación antigénica y los polimorfismos en muchos los antígenos de Plasmodium, podrían explicar el lento desarrollo de la inmunidad.
La observación de que los individuos asintomáticos pueden exhibir altos niveles de parasitemia ha llevado al concepto de “inmunidad contra la enfermedad”. Esto se sumaría a la inmunidad “antiparasitaria” discutida anteriormente que resulta en parasitemias más bajas. El paludismo grave y la muerte se correlacionan con el TNF-α y otras citoquinas proinflamatorias. Como se ha comentado para los paraxismos y la malaria cerebral, los antígenos o toxinas liberados por el eritrocito infectado podrían estimular la producción de citocinas proinflamatorias. Los anticuerpos contra estos exoantígenos posiblemente podrían neutralizar sus efectos tóxicos y, por lo tanto, conducir a una inmunidad contra la enfermedad.
Revisión sobre la inmunidad a la malaria:
J Langhorne, FM Ndungu, AM Sponaas, K Marsh (2008) “Inmunidad a la malaria: más preguntas que respuestas”. Nature Immunology 9, 725 – 732 .
Debido a las dificultades para controlar la malaria por otros medios, existe mucho interés en desarrollar una vacuna contra la malaria. Actualmente no hay una vacuna disponible, pero hay una importante investigación dirigida a identificar vacunas candidatas y probar posibles vacunas para determinar su seguridad y eficacia. El complejo ciclo de vida y la biología del parásito ofrecen varios posibles objetivos (Cuadro 15.9). Por ejemplo, la vacunación contra el esporozoíto o el estadio exoeritrocitario podría prevenir la infección. Sin embargo, la inmunidad inducida necesitaría ser completamente efectiva ya que el escape de un solo esporozoito conduciría a una infección y enfermedad en etapa sanguínea. Las vacunas dirigidas contra los merozoítos o el eritrocito infectado reducirían la parasitemia al interferir con la invasión de merozoítos o aumentar la eliminación de los eritrocitos infectados. Tal vacuna podría potencialmente aliviar gran parte de la patogénesis asociada con la malaria, incluso si no fuera completamente efectiva. Además, la infección puede servir para estimular la respuesta inmunitaria. Puede ser posible vacunar contra la enfermedad mediante la inmunización contra antígenos potencialmente tóxicos. Los anticuerpos que neutralizan los antígenos que estimulan una respuesta inmune proinflamatoria pueden disminuir parte de la patogenia asociada con la malaria. Las etapas sexuales del parásito, como los gametocitos y los gametos, también podrían ser objetivo. Los anticuerpos dirigidos contra los antígenos de los gametos pueden prevenir la infección del mosquito y la esporogonia.
| Estrategias potenciales de vacunas |
|---|
| ObjetivoProteccionMecanismoesporozoitoanti-infecciónprevenir o eliminar la etapa hepáticamerozoitoantiparasitariodisminuir la eficiencia de la invasión de merozoitosglóbulos rojos infectadosantiparasitarioaumentar la eliminación de eritrocitos infectadosexoantígenosanti-enfermedadmenor producción de citocinas inflamatoriasetapas sexualesanti-transmisióneliminar gametos o prevenir la infección de mosquitos |
Genética humana y resistencia innata
| Resistencia innata |
|---|
| – Duffy-negativo – Ovalcitosis – Anemia falciforme – Talasemia – Deficiencia de G6PD |
Ciertas enfermedades genéticas y polimorfismos se han asociado con una disminución de la infección o enfermedad (Recuadro). Por ejemplo, los individuos que carecen del antígeno del grupo sanguíneo Duffy son refractarios a P. vivax . Una gran proporción de las poblaciones de África occidental son negativas para Duffy, lo que explica los bajos niveles de P. vivax en África occidental. Esta resistencia innata condujo a la identificación del antígeno Duffy como el receptor de eritrocitos para la invasión de merozoitos (Véaseinteracciones receptor-ligando durante la invasión de merozoitos).
Varios trastornos hereditarios de eritrocitos se encuentran predominantemente en áreas endémicas de malaria y con frecuencias mucho más altas de lo esperado. Esto ha llevado a la especulación de que estos trastornos confieren cierta protección contra la malaria. Por ejemplo, la ovalcitosis del sudeste asiático se debe a una mutación en una proteína de la membrana de los eritrocitos llamada banda 3. Esta mutación hace que la membrana de los eritrocitos se vuelva más rígida y más refractaria a la invasión de merozoítos. No se conocen los mecanismos por los cuales las otras enfermedades podrían conferir protección contra la malaria. En la mayoría de los casos, se supone o se especula que la combinación del defecto y la infección conduce a la lisis o eliminación prematura del eritrocito infectado. Por ejemplo, los eritrocitos con deficiencia de glucosa-6-fosfato deshidrogenasa (G6PD) tendrían una capacidad reducida para manejar el estrés oxidativo (véase Acción Farmacológica). Los oxidantes adicionales producidos como resultado del metabolismo del parásito y la digestión de la hemoglobina (véase Notas de bioquímica) pueden abrumar al eritrocito infectado y provocar su destrucción antes de que el parásito pueda completar la esquizogonia. También se especula que la anemia de células falciformes y la talasemia hacen que los eritrocitos infectados sean más susceptibles al estrés oxidativo.
Reseñas sobre polimorfismos de glóbulos rojos y malaria:
- G Min-Oo, P Gros (2005) “Variantes de eritrocitos y la naturaleza de su efecto protector contra la malaria”. Microbiología celular 7, 753-763 .
- TN Williams (2006) “Polimorfismos de glóbulos rojos humanos y malaria”. Opinión actual en microbiología 9, 388-394 .
- TN Williams (2006) “Defectos de glóbulos rojos y malaria”. Parasitología Molecular y Bioquímica 149, 121-127 .
| Factores que conducen a una disminución en la transmisión de la malaria en los EE. UU. |
|---|
| – Cambio de población de las zonas rurales a las urbanas – Mejores condiciones socioeconómicas – Drenaje de criaderos – Disponibilidad de quinina – Actividades de control de mosquitos |
Malaria en los Estados Unidos
Anteriormente, la malaria estaba más extendida en áreas templadas, incluidas América del Norte y Europa. Se cree que la malaria fue introducida en las Américas por los colonos europeos (P. vivax y P. malariae) y los esclavos africanos (P. falciparum) durante los siglos XVI y XVII. La malaria se volvió endémica en muchas partes de los Estados Unidos, excluyendo los desiertos y las áreas montañosas, y la incidencia probablemente alcanzó su punto máximo alrededor de 1875. Un cambio de población de áreas rurales a urbanas, drenaje de pantanos para crear tierras de cultivo, vivienda y nutrición mejoradas, mejores condiciones socioeconómicas y estándares de calidad de vida, así como, un mayor acceso a los servicios médicos y la disponibilidad de quinina para el tratamiento contribuyeron a la disminución de la prevalencia de la malaria incluso antes de la introducción de medidas de control específicas (Recuadro). Algunas actividades de control, tales como detección y tratamiento de casos, aplicación de larvicidas y fumigación de casas, se introdujeron durante la década de 1940 y condujeron a la erradicación de la malaria en los Estados Unidos. Desde la década de 1950, casi todos los casos de malaria en los EE. UU. han sido importados. Los principales factores que contribuyeron a esta erradicación parecen ser un cambio de población de las áreas rurales a las urbanas y un aumento en el nivel de vida, lo que resultó en mejores viviendas, mejor nutrición y mayor acceso a los servicios médicos.
La gran mayoría de los casos de malaria diagnosticados en los Estados Unidos son adquiridos por personas que viajan a países donde la malaria es endémica. Sin embargo, durante la década de 1990 hubo varios brotes de transmisión autóctona de malaria en los Estados Unidos (Zucker, 1996). Estos brotes se asociaron con áreas densamente pobladas y un gran número de inmigrantes. Más del 80% de los casos fueron P. vivax. Además, los brotes se asociaron con un clima inusualmente cálido y húmedo, lo que puede aumentar la supervivencia de los anofelinos y disminuir la duración del ciclo esporogónico, lo que permite el desarrollo de esporozoítos infecciosos (Véase también informe reciente sobre siete casos de P. vivax adquiridos localmente que ocurrió en Florida durante julio-agosto de 2003, MMWR 52:908).
| Reducir el contacto humano-mosquito – Mosquiteros impregnados – Repelentes, ropa protectora – Pantallas, fumigación de casas Reducir la densidad de vectores – Modificación ambiental – Larvicidas/insecticidas – Control biológico Reducir el reservorio de parásitos – Detección y tratamiento de casos – Quimioprofilaxis |
Prevención y control
Las estrategias para prevenir y controlar la malaria involucran tres enfoques diferentes (véase Cuadro). La prevención de la malaria en individuos generalmente implicará la reducción del contacto entre humanos y mosquitos mediante el uso de mosquiteros, repelentes, etc. También se puede usar la quimioprofilaxis (véase más abajo), especialmente en viajeros. Sin embargo, la quimioprofilaxis solo suprime la parasitemia y no previene la infección.
Las actividades de control a nivel comunitario pueden utilizar enfoques que reduzcan directamente el contacto humano-mosquito, así como enfoques que reduzcan el número total de mosquitos en un área. Dichos enfoques incluyen la reducción de los criaderos de mosquitos (p. ej., modificación ambiental), atacar las etapas de larva con agentes químicos o biológicos y la fumigación masiva de insecticidas para los mosquitos adultos. Los métodos de control biológico incluyen la introducción de peces que se alimentan de larvas de mosquitos o bacterias (p. ej., Bacillus thuringiensis) que excretan toxinas larvales. La detección y el tratamiento de casos es otro posible método de control. Identificar y tratar a las personas infectadas, especialmente a las personas asintomáticas, reducirá el tamaño del reservorio de parásitos dentro de la población humana y puede reducir las tasas de transmisión. Sin embargo, esto puede ser un enfoque relativamente costoso.
Estos enfoques no son mutuamente excluyentes y pueden combinarse. Muchos de los programas de control exitosos incluyen medidas para controlar los mosquitos y el tratamiento de las personas infectadas. No existe un método estándar de control de la malaria que haya demostrado ser universalmente efectivo. Los factores epidemiológicos, socioeconómicos, culturales y de infraestructura de una región en particular determinarán el control de la malaria más apropiado. Algunos de los factores que deben ser considerados incluyen:
- Infraestructura de los servicios de salud existentes y otros recursos
- Intensidad y periodicidad (p. ej., estacionalidad) de la transmisión
- Especies de mosquitos (requisitos ecológicos, características de comportamiento, sensibilidad a los insecticidas, etc.)
- Especies de parásitos y sensibilidades a los medicamentos
- Características culturales y sociales de la población
- Presencia de cambios sociales y ecológicos
El control de la malaria en África tropical ha sido particularmente problemático debido a las altas tasas de transmisión y al bajo nivel socioeconómico general. Varios estudios han demostrado que las mosquiteras tratados con insecticida (ITBN) reducen la morbilidad y la mortalidad asociadas con la malaria. En la mayoría de las áreas, la introducción de mosquiteros no requiere grandes programas de promoción y su uso se acepta fácilmente. Esto puede deberse en parte a la reducción de las molestas picaduras de mosquitos. Se han planteado algunas preguntas con respecto a la sostenibilidad económica de los programas de mosquiteros. Es necesario volver a tratar las mosquiteras con insecticida periódicamente y deben repararse y reemplazarse a medida que se rompen y se desgastan. Además, algunos han expresado su preocupación por los beneficios a largo plazo, ya que reducen la exposición, pero no los elimina. Esta reducción de la exposición puede retrasar la adquisición de la inmunidad y simplemente posponer la morbilidad y la mortalidad a grupos de mayor edad.
[Revisión sobre el control de la malaria: RS Phillips (2001) “Estado actual de la malaria y potencial para el control”. clin. Microbiol. Apocalipsis 14:208.]
Diagnóstico
- Historia de la zona endémica
- Síntomas: fiebre, escalofríos, dolor de cabeza, malestar
- Plenomegalia, anemiademostración microscópica del parásito (frotis de sangre)
- Detección de antígenos (p. ej., BinaxNOW Malaria, ParaSight-F, OptiMal)
- Amplificación por PCR del ADN del parásito
Se sospecha paludismo en personas con antecedentes de haber estado en un área endémica y que presentan síntomas compatibles con paludismo (ver Manifestaciones clínicas). Estos síntomas, especialmente en las primeras etapas de la infección, no son específicos y, a menudo, se describen como similares a los de la gripe. A medida que avanza la enfermedad, el paciente puede presentar agrandamiento del bazo y/o del hígado y anemia. El diagnóstico se confirma por microscopía. Los frotis de sangre gruesos son generalmente más sensibles para la detección de parásitos, mientras que los frotis finos son preferibles para la identificación de especies (Véase la morfología del estadio sanguíneo de Plasmodiumespecie). Si no se encuentran parásitos en el primer frotis de sangre, se recomienda hacer frotis adicionales cada 6-12 horas durante un máximo de 48 horas. Un diagnóstico tentativo de P. falciparum (numerosos y exclusivamente estadios anulares) podría constituir una emergencia médica, especialmente en una persona no inmune. También se encuentran disponibles pruebas inmunocromatográficas rápidas (es decir, tiras reactivas) basadas en la detección de antígenos (ver revisión).
Quimioterapia y resistencia a los medicamentos
Hay varios medicamentos antipalúdicos disponibles. Se tienen en cuenta muchos factores en la decisión del mejor tratamiento para la malaria. Estos factores incluyen la especie del parásito, la gravedad de la enfermedad (p. ej., complicada), la edad y el estado inmunitario del paciente, la susceptibilidad del parásito a los fármacos (es decir, la resistencia a los fármacos) y el coste y la disponibilidad de los fármacos. Por lo tanto, las recomendaciones exactas a menudo variarán según la región geográfica. Además, los distintos fármacos actúan de forma diferencial en las distintas etapas del ciclo de vida (tabla). Otros enlaces de interés:
- Mecanismos de acción y resistencia a fármacos
- Hospital Naval Virtual, información sobre tratamientos y antipalúdicos
- OMS, guía sobre el uso de antipalúdicos
- Artículo de Carta Médica sobre Medicamentos para Infecciones Parasitarias
| Medicamentos antipalúdicos seleccionados |
|---|
| Clase de medicamentos Esquizonticida sanguíneo de acción rápida: cloroquina (+ otras 4-aminoquinolinas), quinina, quinidina, mefloquina, halofantrina, antifolatos (pirimetamina, proquanil, sulfadoxina, dapsona), derivados de la artemisinina (quinhaosu) Esquizonticida hemático de acción lenta: doxiciclina (+ otros antibióticos de tetraciclina) Sangre + esquizonticida tisular leve: proquanil, pirimetamina, tetraciclinas Esquizonticida tisular (antirrecidivante): primaquina Gametocida: primaquina, derivados de la artemisinina, 4-aminoquinolinas (¿limitado?) Combinaciones: Fansidar (pirimetamina + sulfadoxina), Maloprim (pirimetamina + dapsona), Malarone (atovacuona + proquanil) |
Los esquizonticidas sanguíneos de acción rápida, que actúan sobre el estadio sanguíneo del parásito, se utilizan para tratar infecciones agudas y aliviar rápidamente los síntomas clínicos. La cloroquina es generalmente el tratamiento recomendado para pacientes con infecciones por P. vivax , P. ovale , P. malariae y P. falciparum sensibles a la cloroquina sin complicaciones . La cloroquina es segura y generalmente bien tolerada. Los efectos secundarios pueden incluir prurito (es decir, picazón), náuseas o agitación. Pacientes infectados con P. vivax o P. ovale, y que no tienen un alto riesgo de reinfección, también deben tratarse con primaquina (un esquizonticida tisular). La primaquina es eficaz contra la etapa hepática del parásito, incluidos los hipnozoítos (ver recaídas), y evitará futuras recaídas. La combinación de cloroquina y primaquina a menudo se denomina “cura radical”.
El paludismo falciparum grave o complicado es una enfermedad grave con una alta tasa de mortalidad y debe considerarse potencialmente mortal y, por lo tanto, requiere tratamiento urgente. El tratamiento normalmente requiere la administración parenteral del fármaco (es decir, inyecciones) ya que los pacientes a menudo están en coma o con vómitos y, por lo tanto, no pueden tomar los fármacos por vía oral. Las formulaciones parenterales están disponibles para derivados de cloroquina, quinina, quinidina y artemisinina. Los derivados de la artemisinina son generalmente la opción preferida, pero aún no están aprobados en todas partes. Por ejemplo, en los Estados Unidos, la quinina y la quinidina son los medicamentos aprobados para la malaria grave. Los pacientes deben ser monitoreados continuamente en cuanto a hematocrito, parasitemia, niveles de hidratación, hipoglucemia y signos de toxicidad por fármacos y otras complicaciones durante el curso del tratamiento. Se debe cambiar a la administración oral tan pronto como el paciente pueda hacerlo. La mayoría de las muertes por paludismo grave ocurren en el hogar o cerca de él, en situaciones en las que los pacientes no pueden ser trasladados al hospital. También se han desarrollado supositorios de artemisinina que pueden ser administrados por los trabajadores de salud de las aldeas y han demostrado ser seguros y eficaces.
La eficacia de la cloroquina se ve muy disminuida por la resistencia generalizada de P. falciparum a la cloroquina y la aparición de P. vivax resistente a la cloroquina . Si la terapia con cloroquina no es efectiva, o si se encuentra en un área con malaria resistente a la cloroquina, los tratamientos alternativos comunes incluyen: mefloquina, quinina en combinación con doxiciclina o Fansidar®. Los derivados de la artemisinina (dihidroartemisinina, artesunato y arteméter) se usan cada vez más en Asia y África y ahora la Organización Mundial de la Salud los recomienda como primera línea de tratamiento. Estos medicamentos se derivaron originalmente de la planta de ajenjo ( Artemesia annua) y se han utilizado durante mucho tiempo en China como un té de hierbas llamado quinhaosu para tratar enfermedades febriles. Para prevenir las altas tasas de recrudecimiento asociadas con los derivados de la artemisinina y para retrasar el desarrollo de resistencia a los medicamentos, se recomienda combinar el tratamiento con un antipalúdico no relacionado. Los medicamentos que se usan en combinación con artemisinina incluyen mefloquina, lumefantrina, Fansidar® y amodiaquina.
Quimioprofilaxis . La quimioprofilaxis es especialmente importante para las personas de áreas no palúdicas que visitan áreas endémicas de malaria. Estas personas no inmunes pueden desarrollar rápidamente una enfermedad grave y potencialmente mortal. Como en el caso del tratamiento, no existe una recomendación estándar y las opciones de quimioprofilaxis dependen en gran medida de las condiciones asociadas con el viaje y la persona individual. (Consulte la hoja informativa de los CDC sobre la prevención de la malaria.) La quimioprofilaxis requiere el uso de medicamentos no tóxicos, ya que estos medicamentos se tomarán durante largos períodos de tiempo. Generalmente, el paciente comenzará a tomar el medicamento antes de viajar y luego continuará tomándolo durante la estancia en el área endémica y continuará tomándolo después de regresar. Esto es para asegurar que el medicamento se mantenga en niveles suficientes durante toda la visita y para proteger contra cualquier infección adquirida durante la visita. Desafortunadamente, muchos de los medicamentos efectivos y no tóxicos (p. ej., cloroquina, pirimetamina, proquanil) tienen un uso limitado debido a la resistencia a los medicamentos. Otra estrategia es el tratamiento presuntivo (o “en espera”) que se utilizará junto con la profilaxis.
El uso de mefloquina para la quimioprofilaxis del paludismo es algo controvertido. La mefloquina es eficaz en la prevención de la malaria con una sola toma por semana, por lo que ofrece ventajas a los medicamentos que deben administrarse diariamente. A esta dosis, la mayoría de las personas tolera la mefloquina. Sin embargo, algunas personas experimentan efectos adversos neuropsiquiátricos, como trastornos del sueño y pesadillas. Esto podría verse exacerbado por los viajes internacionales, que son situaciones estresantes. Los ensayos aleatorizados, ciegos y controlados indican que los efectos adversos neuropsiquiátricos son solo ligeramente mayores con la mefloquina que con otros antipalúdicos.
Matar la etapa exoeritrocítica (es decir, el hígado) evitaría la infección de la sangre y se conoce como profilaxis causal. Esto es muy deseable porque limita la cantidad de tiempo que se necesita tomar el fármaco profiláctico antes y después de viajar a un área endémica. El único fármaco actualmente disponible para la profilaxis causal es la primaquina. Sin embargo, la profilaxis de la malaria no es un uso aprobado de la primaquina y solo debe recetarse para la profilaxis caso por caso. Por ejemplo, para personas que frecuentemente realizan viajes de corta duración a áreas altamente endémicas y que la persona no presenta deficiencia de glucosa-6-fosfato deshidrogenasa. La tafenoquina se encuentra actualmente en evaluación de campo para su uso en la profilaxis causal.
Reseñas sobre el tratamiento de la malaria:
- Pasvol G (2006) “El tratamiento de la malaria grave y complicada”. Br Med Bull 75-76: 29-47 .
- Newton P y White NJ (1999) “Paludismo: nuevos avances en el tratamiento y la prevención”. Annu Rev Med 50:179.
- White NJ (1996) “El tratamiento de la malaria”. N Engl J Med 335:800.
- White NJ (2008) “Qinghaosu (artemisinina): El precio del éxito”. Ciencia 320, 330-334 .
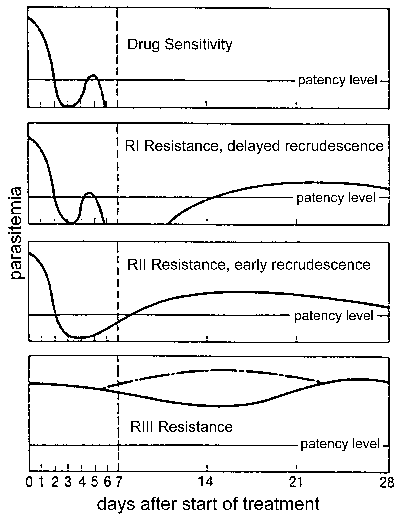
Resistencia a los medicamentos
La resistencia a los medicamentos y, en particular, la resistencia a la cloroquina es un importante problema de salud pública en el control de la malaria. La resistencia a los medicamentos se define por el fracaso del tratamiento y se puede clasificar en diferentes niveles según el momento del recrudecimiento después del tratamiento (Figura). Tradicionalmente, estos niveles de resistencia a los medicamentos se han definido como sensibles (sin recrudecimiento), RI (recrudecimiento tardío), RII (recrudecimiento temprano) y RIII (efecto antiparasitario mínimo o nulo). En 1996, la OMS introdujo un protocolo modificado basado en el resultado clínico. En este protocolo, el nivel de resistencia se expresa como respuesta clínica adecuada (ACR), fracaso tardío del tratamiento (LTF) o fracaso temprano del tratamiento (ETF), según lo definido por lo siguiente:
- ACR, ausencia de parasitemia (independientemente de la fiebre) o ausencia de síntomas clínicos (independientemente de la parasitemia) en el día 14 de seguimiento
- LTF, reaparición de síntomas o presencia de parasitemia durante los días 4-14 de seguimiento
- ETF, persistencia de síntomas clínicos en presencia de parasitemia durante los primeros 3 días de seguimiento
Cualquiera de los protocolos se puede utilizar para determinar la resistencia a los medicamentos, pero el protocolo de resultado clínico es más práctico en áreas de transmisión intensa donde puede ser difícil distinguir entre reinfección y recrudecimiento y donde es común la parasitemia en ausencia de síntomas clínicos. La resistencia a los medicamentos mediante cualquiera de los protocolos se determina con pruebas in vivo en las que los pacientes son hospitalizados y monitoreados durante y después del tratamiento farmacológico estándar. También hay pruebas in vitro que pueden estimar el nivel de resistencia a los medicamentos al determinar la eficacia de los medicamentos contra P. falciparum cultivada (ver Resistencia a los medicamentos: Malaria de la OMS). Las pruebas in vivo e in vitro no siempre se corresponden, ya que la inmunidad del huésped y otros factores pueden afectar los resultados in vivo. La identificación de mutaciones específicas que podrían estar asociadas con la resistencia a los medicamentos (consulte la tabla en la otra página) también puede conducir al desarrollo de pruebas basadas en marcadores moleculares.
La resistencia a los medicamentos se desarrolla cuando los parásitos con sensibilidad disminuida a los medicamentos antipalúdicos se seleccionan bajo la presión de los medicamentos. La disminución de la sensibilidad a los medicamentos puede ser conferida por varios mecanismos (ver Mecanismos de resistencia a los medicamentos) y refleja mutaciones genéticas o polimorfismos en la población de parásitos. Los parásitos farmacorresistentes tendrán una ventaja selectiva sobre los parásitos sensibles a los fármacos en presencia del fármaco y se transmitirán preferentemente. Los principales factores en el desarrollo de la resistencia a los medicamentos son el uso de dosis subterapéuticas de los medicamentos o no completar el régimen de tratamiento (Tabla). Los niveles más bajos de fármaco eliminarán los parásitos más susceptibles, pero aquellos que puedan tolerar el fármaco se recuperarán y reproducirán. Con el tiempo, esto conducirá a una selección continua de parásitos que pueden tolerar dosis aún más altas del fármaco. Es fundamental mantener una concentración adecuada del fármaco durante un tiempo suficiente para eliminar por completo los parásitos de cualquier individuo.
| Factores que contribuyen al desarrollo y propagación de la farmacorresistencia |
|---|
| Automedicación: las personas solo pueden tomar el medicamento hasta que desaparezcan los síntomas o tomarán dosis más bajas para ahorrar dinero. Cumplimiento deficiente: es posible que las personas no completen el curso completo del tratamiento debido a los efectos secundarios de los medicamentos. Administración masiva: el uso generalizado de una droga en un área de transmisión intensa aumenta la presión de las drogas al exponer a una mayor población de parásitos a la droga. Vida media de los fármacos de larga duración: los fármacos que se eliminan lentamente darán lugar a una exposición más prolongada del parásito a concentraciones subterapéuticas del fármaco. Intensidad de transmisión: los altos niveles de transmisión pueden permitir la reinfección mientras los medicamentos se encuentran en niveles subterapéuticos. |
Resistencia a la cloroquina. Después de su introducción cerca del final de la Segunda Guerra Mundial, la cloroquina se convirtió rápidamente en el fármaco de elección para el tratamiento y la prevención de la malaria. La cloroquina no solo es un fármaco eficaz, probablemente debido a su sitio de acción en la vacuola de los alimentos y su interferencia con la formación de hemozoínas (ver acción del fármaco), sino que también es relativamente no tóxico y económico. Se detectaron dos focos de P. falciparum resistentes a la cloroquina en Colombia y en la frontera entre Camboya y Tailandia a fines de la década de 1950. Durante las décadas de 1960 y 1970, los parásitos resistentes se extendieron por América del Sur, el Sudeste Asiático y la India. La resistencia se informó por primera vez en el este de África en 1978 y se extendió por todo el continente durante la década de 1980. P. vivax resistente a la cloroquinano se informó hasta 1989 en Papua Nueva Guinea y ahora se encuentra en varios focos en el sureste de Asia y quizás en América del Sur.
La base de la resistencia a la cloroquina es la reducción de la acumulación de cloroquina en la vacuola alimenticia del parásito. Además, la resistencia a la cloroquina se puede revertir parcialmente con inhibidores de la glicoproteína P (un transportador ABC) que son responsables de la resistencia a múltiples fármacos (MDR) en líneas de células tumorales, lo que sugiere que puede ocurrir un fenómeno similar en Plasmodium . Las mutaciones en un gen similar a MDR de P. falciparum ( Pf mdr1) estuvieron implicadas en la resistencia a la cloroquina. Sin embargo, estas mutaciones no predicen la resistencia a la cloroquina en todas las áreas geográficas. Pf MDR1 parece contribuir al grado de resistencia a la cloroquina, pero por sí solo es insuficiente para conferir resistencia. Sin embargo, pfMDR1 parece desempeñar un papel en la resistencia a la mefloquina y la halofantrina e influye en la sensibilidad a la artemisinina.
Otro candidato para el locus genético de la resistencia a la cloroquina se identificó a través de un cruce genético y un experimento de mapeo. Se encontró que una región de 400 kb en el cromosoma 7 se segregaba con resistencia a la cloroquina y análisis posteriores sugirieron que un solo gen, llamado Pf crt, era responsable de la resistencia a la cloroquina. De un total de 10 polimorfismos identificados en este gen, solo una única mutación se asocia perfectamente con el fenotipo de resistencia a la cloroquina. Esta mutación da como resultado que una lisina en el residuo 76 se cambie a una treonina (K76T). Varios estudios de campo han demostrado una asociación entre Pfcrt-K76T y resistencia a la cloroquina utilizando métodos in vivo e in vitro. Recientemente se ha sugerido que ha habido al menos 4 mutaciones fundadoras en el gen Pf crt asociadas con diferentes regiones geográficas: Asia/África, Papua Nueva Guinea, Brasil/Perú y Colombia (Wootton et al, Nature 418:320, 2002 ). Presumiblemente, el uso de cloroquina dio como resultado la posterior selección y propagación del fenotipo resistente.
Comentarios sobre la resistencia a los medicamentos:
- Boland PB (2001) “Resistencia a los medicamentos en la malaria”. OMS/CDS/CSR/DRS/2001.4
- Hyde JE (2007) “Paludismo resistente a los medicamentos: una idea”. Revista FEBS 274, 4688-4698 .
- Warhust D (2001) “Nuevos desarrollos: resistencia a la cloroquina en Plasmodium falciparum” Actualizaciones sobre la resistencia a los medicamentos 4:141.
- Wellems TE y Plowe CV (2001) “Paludismo resistente a la cloroquina”. J Inf Dis 184:770.
- Wongsrichanalai C, Pickard AL, Wernsdorfer WH y Meshnick SR (2002) “Epidemiología de la malaria resistente a los medicamentos”. Lancet Infect Dis 2:209.
ENLACES
- Parte superior
- Ciclo vital
- Manifestaciones clínicas
- Patogenia y paludismo cerebral
- Mecanismo de citoadherencia ( Pf EMP-1)
- Epidemiología
- Prevención y control
- Diagnóstico
- Quimioterapia y resistencia a los medicamentos
- Protozoología Inicio
- Otros cursos y conferencias
- Hogar más sabio
- Otros sitios de Internet
- Centros para el control de enfermedades
- Hospital Naval Virtual
- Traducción al bosnio de esta página web
- Traducción finlandesa de esta página web
- Traducción al estonio de esta página web
- Traducción al serbio de esta página web
- Traducción al ruso de esta página web
- Traducción al ucraniano de esta página web
- Traducción al malayo de esta página web
- Traducción al polaco de esta página web
- Traducción al turco de esta página web
- Traducción al macedonio de esta página web
Estas páginas son desarrolladas y mantenidas por Mark F. Wiser, Universidad de Tulane (©2000). Última actualización el 25 de septiembre de 2020 .